Cos'è il foglietto illustrativo del farmaco?
Un foglietto illustrativo approvato FDA è un documento scritto dall'azienda produttrice di un certo farmaco in collaborazione con la Food and Drug Administration (FDA). Il suo scopo è fornire a medici e pazienti informazioni chiave riguardo a un determinato farmaco. Queste informazioni riguardano le sue principali caratteristiche chimiche, alcuni dei rischi conosciuti, le sue possibili interazioni farmacologiche e molto altro. Il foglietto illustrativo contiene informazioni di inestimabile importanza per capire come agisce la sostanza e condurre uno scalaggio più sicuro possibile.
Ricordati che i bugiardini inseriti nella confezione del farmaco spesso sono solo un breve riassunto del foglietto illustrativo completo degli psicofarmaci. Il bugiardino completo, d'altra parte, è principalmente rivolto ai professionisti della salute; esso può essere lungo tra le 10 e le 50 pagine, ma a volte anche di più.
Ti può essere già capitato che il tuo medico ti abbia prescritto un farmaco in modalità off label, cioè senza autorizzazione specifica da parte delle autorità regolatrici. Questo significa, per esempio, che il farmaco in questione non ha ricevuto l’approvazione per il tuo gruppo di età o per una certa patologia. Motivo per cui il foglietto illustrativo potrebbe non contenere informazioni specifiche riguardo gli effetti avversi relativi alla tua fascia di età. Ciononostante, all’interno sono sempre contenute informazioni utili per capire l’azione del farmaco e condurre lo scalaggio il più sicuro possibile.
Come procurarsi i foglietti illustrativi
Alcune farmacie su richiesta stampano copie di foglietti illustrativi - ma è sempre meglio procurarsi la versione completa online rispetto al riassunto semplificato di poche pagine. Dal momento che i siti commerciali mostrano spesso una versione modificata dei foglietti illustrativi, i più affidabili e aggiornati sono reperibili sui siti governativi ufficiali.
- U.S. National Library of Medicine “DailyMed” website
Questo sito web fornisce l'accesso ai bugiardini dei farmaci passati e presenti, sia per quelli sotto brevetto che per i generici. A volte fornisce anche informazioni correlate, come i collegamenti agli studi clinici relativi al farmaco in questione.
- U.S. Food and Drug Administration “Drugs@FDA” database
Fornisce l'accesso agli studi che sono serviti a far ottenere l’approvazione del farmaco, il quale, insieme ai foglietti illustrativi, può fornire lo storico della letteratura scientifica sul tema, la revisione statistica, la corrispondenza tra FDA e aziende farmaceutiche, e altre informazioni. Nota: su questo sito si trovano solo i foglietti illustrativi dei farmaci sotto licenza (e non i generici)..
Suggerimenti per la ricerca:
-
Per identificare il nome completo del farmaco usa la confezione/ foglietto illustrativo del farmaco, oppure domanda ad un farmacista. Bada se il nome sulla confezione include sia il nome commerciale che un nome generico o solo il nome generico, e se ci sono dei supplementi come sigle o descrizioni della formulazione (Es. "Adderall XR" o "Depakote - compresse di valproato sodico a rilascio ritardato"). Usa il nome completo del farmaco per condurre la ricerca del suo foglietto illustrativo.
-
Se si tratta di un farmaco con brevetto, cerca usando il nome commerciale completo (Es. Abilify in compresse / aripiprazolo).
-
Per cercare il foglietto illustrativo di un generico, abbina il nome del principio attivo al nome dell’azienda farmaceutica produttrice. Se il foglietto non contiene tutte le sezioni numerate descritte in seguito, è probabile non sia aggiornato. Si consiglia di verificare se esiste un foglietto illustrativo più recente per la stessa versione del farmaco ma di un produttore diverso.
-
Assicurati sempre di star visualizzando la versione più recente del bugiardino. La data si trova all'inizio o alla fine del documento, o in caso più raro a margine. Inoltre, diverse sezioni del bugiardino possono avere date di aggiornamento diverse.
-
Un'altra opzione è cercare informazioni sul tuo farmaco nel database della U.S. Food and Drug Administration "Medication Guides". Le Medication Guides sono versioni accorciate dei foglietti illustrativi, specificamente pensate per essere più accessibili ai consumatori. Non sempre esistono Medication Guides per ogni farmaco, quando ci sono sono spesso già incluse nella sezione supplementare della versione completa del bugiardino.
Qual è il contenuto del foglietto illustrativo?
I foglietti illustrativi più recenti spesso iniziano con una o due pagine di riassunto seguite da una tabella che contiene informazioni più dettagliate. Nonostante il grande numero di informazioni che contengono, solitamente non sono da considerare documenti completi, bensì un semplice riassunto degli aspetti più importanti che sono giunti all’attenzione della FDA circa un particolare farmaco. In aggiunta, le normative riguardo i foglietti illustrativi sono cambiate nel corso degli anni, motivo per cui le sottosezioni, l’ordine delle informazioni, e altri dettagli che possono variare in base a diversi fattori, come quanto a lungo è durato il brevetto commerciale e quanto sia datato l’ultimo aggiornamento dei foglietti illustrativi. Per queste ragioni, se un problema specifico non è stato incluso in un bugiardino, non garantisce che quel problema non sia collegato con il farmaco in questione. Nei casi in cui è in gioco la propria salute è fondamentale documentarsi sul tema e consultare un medico o un farmacista bene informati. A seguire troverai le sezioni principali delle attuali versioni dei foglietti illustrativi, insieme a una selezione delle informazioni di maggior interesse per lo scalaggio.
Tipici contenuti di un foglietto illustrativo
Avvertenze nel riquadro nero (black box warnings)

- Se c’è un avvertimento particolarmente importante riguardo un rischio grave questo viene indicato in un riquadro nero all’inizio del bugiardino o dopo l’indice.
1. Indicazioni e uso
- Elenco dei principali disturbi per cui quel farmaco ha ricevuto approvazione.
- Può includere un breve riassunto degli studi forniti dall’azienda produttrice per ottenere l’approvazione FDA.
2. Dosaggio e somministrazione
Informazioni sul dosaggio consigliato, il quale dipende da variabili come l’età, condizioni mediche preesistenti, eventuali diagnosi psichiatriche e altri farmaci che si stanno assumendo.
- Può inoltre includere informazioni su come variare il dosaggio a seconda del proprio patrimonio genetico, su come il farmaco viene metabolizzato e su quali altri farmaci una persona può continuare ad assumere o deve interrompere.
- Può includere informazioni sull’assunzione dei granuli al di fuori delle capsule originali, e/o come i granuli delle capsule aperte debbano o non debbano venir consumate.
- Può includere informazioni su dosaggi equivalenti tra formulazioni a rilascio modificato e formulazioni a rilascio immediato.
- Può includere informazioni sui rischi legati alla sospensione del farmaco.
- Può contenere informazioni su come interrompere il farmaco. Nota bene: i tassi di riduzione indicati in tutti i foglietti illustrativi FDA sono considerati da noi esperti per esperienza troppo veloci e di conseguenza altamente rischiosi.
3. Posologia e dosaggi in cui il farmaco è disponibile

- Un elenco dei diversi dosaggi disponibili della versione del farmaco relativa a quel foglietto illustrativo. Ricorda che un foglietto illustrativo è solitamente legato alla composizione del farmaco di un'azienda specifica: di norma non conterrà informazioni riguardo alle versioni dello stesso farmaco sviluppato da compagnie farmaceutiche diverse, anche se operano nello stesso Paese - per informazioni complessive, fai riferimento al FDA’s Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations. Per maggiori informazioni segui questo link e fai riferimento al paragrafo “Come trovare le altre forme e formulazioni disponibili di un farmaco” dello Step 11.)
4. Controindicazioni
- Reazioni e condizioni pre esistenti che presentano un rischio particolarmente alto per le persone che assumono il farmaco, inclusa l’assunzione concomitante di altri psicofarmaci o altri farmaci in generale.
5. Avvertenze e precauzioni
Una sintesi di alcuni degli effetti avversi più comunemente osservati o pericolosi, considerati abbastanza seri da dover fornire un’avvertenza specifica.
Può includere informazioni sulla metabolizzazione del farmaco e su eventuali "interazioni farmacologiche clinicamente importanti".
Talvolta include informazioni sulla sindrome da sospensione o sui sintomi di astinenza in generale.
6. Reazioni avverse
Una selezione di alcuni degli effetti avversi più comuni del farmaco, in particolare di quelli osservati durante gli studi clinici utilizzati per ottenere l’approvazione da parte della FDA.
A volte può includere informazioni riguardo la sindrome da sospensione o i sintomi di astinenza.
7. Interazioni tra farmaci
Una serie di farmaci o classi farmaceutiche con cui il farmaco in questione ha delle interazioni particolarmente pericolose e preoccupanti da un punto di vista chimico, come quelle che comportano un aumento o una diminuzione dell’effetto del farmaco sull’organismo. *Può richiedere conoscenze specifiche in farmacologia.
Può includere informazioni riguardo al metabolismo del farmaco e a come l’azione dei farmaci influenzi la funzione metabolica.
8. Uso in popolazioni specifiche
- Una selezione dei danni potenziali che il farmaco può causare in sottopopolazioni specifiche, come donne in gravidanza, madri in allattamento, bambini, anziani e soggetti geneticamente non predisposti a metabolizzare una certa sostanza.
9. Abuso e dipendenza
Si indica se il farmaco ha potenziale rischio di abuso che può portare ad assunzioni molto frequenti o ad alti dosaggi.
Informazioni sulla capacità del farmaco di causare dipendenza anche a dosi terapeutiche e con un numero di assunzioni regolari.
A volte può includere informazioni riguardo i sintomi comuni della dipendenza fisica, psicologica o entrambe.
Può contenere informazioni riguardo i più comuni sintomi di astinenza.
10. Sovradosaggio
- Informazioni sui dosaggi con cui il farmaco può causare reazioni gravemente tossiche o potenzialmente fatali.
11. Descrizione
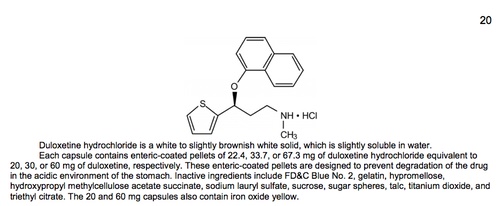
Identifica la struttura chimica del farmaco e qualche volta fornisce il nome chimico completo. Descrive la quantità di principio attivo in diverse forme e composizioni, inoltre elenca gli ingredienti “inattivi” come eccipienti e coloranti.
Può indicare la solubilità relativa del farmaco.
Può contenere informazioni sulle particolari tecnologie di formulazione a rilascio modificato impiegate nel farmaco e su come queste agiscano nell’organismo.
12. Farmacologia clinica
Descrive l’azione del farmaco a livello biologico e come agisca per trattare le condizioni per cui è approvato.
La sezione “Farmacodinamica” fornisce un riassunto riguardo al meccanismo d’azione biologico del farmaco e al suo effettivo funzionamento nell’organismo.
La sezione “Farmacocinetica” fornisce informazioni su come l’organismo gestisce il farmaco, ovvero il suo tempo di eliminazione (cioè l’emivita), quanto tempo impiega il farmaco a raggiungere il picco di concentrazione e ad essere completamente eliminato dall’organismo.
Può includere maggiori informazioni riguardo la bioequivalenza tra diverse forme e formulazione del farmaco.
La sezione “Metabolismo ed eliminazione” può includere dettagli sulla maniera con cui il farmaco viene metabolizzato ed eliminato dal corpo, comprese le informazioni relative ai geni e agli enzimi.
13. Tossicologia non clinica
- Di solito è basata su studi di laboratorio con modello animale; può includere informazioni relative ai rischi che il farmaco in questione possa causare cancro, difetti alla nascita, mutazioni genetiche, compromissione della fertilità, e altri effetti avversi di questo tipo.
14. Studi clinici

- Può includere un riepilogo generale e dei dettagli sulla presunta efficacia del farmaco, basati sugli studi che l’azienda produttrice ha inviato alla FDA per ottenere l’approvazione (nota: l’azienda produttrice può aver condotto altri studi sul farmaco in questione - ma questi studi solitamente non vengono menzionati nella parte di foglietto illustrativo relativa al disturbo specifico per il quale il farmaco è stato approvato).
15. Riferimenti
- Citazioni a scopo informativo – solitamente non incluse.
16. Come il farmaco viene fornito, come deve essere conservato ed eventualmente manipolato
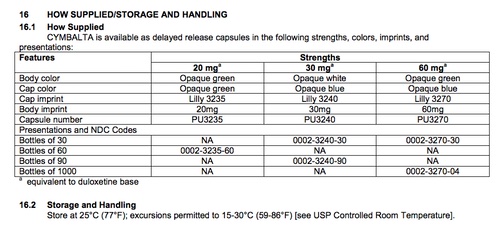
- Un elenco delle versioni in cui il farmaco è disponibile. Si noti che l'etichetta di un singolo farmaco di solito non include elenchi delle versioni prodotte da produttori diversi - per queste informazioni complessive, fai riferimento al documento della FDA Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations. (Per maggiori informazioni seguire questo link o visita la pagina “Come trovare altre forme e formulazioni disponibili di un farmaco” dello Step 11.)
- Include informazioni sulle corrette procedure di conservazione, compresi i contenitori adatti e le temperature appropriate.
17. Informazioni sulla consulenza al paziente
- Istruzioni rivolte ai medici su aspetti problematici del farmaco di cui dovrebbero informare i pazienti.
+ Guida ai farmaci e altre informazioni
- I foglietti illustrativi dei farmaci più recenti possono avere una serie di sezioni supplementari; ad esempio la “Medication Guide”, progettata per riassumere e aiutare i consumatori a capire il significato di alcune delle informazioni più importanti su quel farmaco. I foglietti illustrativi possono anche includere immagini dei bugiardini e delle confezioni del farmaco, descrizioni del prodotto, una lista degli ingredienti inattivi e altre informazioni.

